Giá trị pH của dung dịch NaOH?
Độ pH của NaOH là bao nhiêu? Giải đáp cụ thể kể từ A-Z Mô tả ngắn chuẩn SEO: Tìm hiểu độ pH của NaOH (Natri Hydroxit) trong những dung dịch khác nhau. Bài viết cung cấp thông tin cụ thể về tính chất chất hóa học, ứng dụng và cơ hội dùng NaOH an toàn và đáng tin cậy. Quý Khách có khi nào tự hỏi độ pH của NaOH là bao nhiêu? Natri Hydroxit (NaOH), một hợp hóa học hóa học quan tiền trọng, đóng góp vai trò không thể thiếu thốn trong nhiều ngành công nghiệp và ứng dụng không giống nhau. Từ sản xuất giấy, xà chống, đến xử lý nước thải và các thử nghiệm vào chống thực nghiệm, NaOH luôn là một trong những thành phần không thể thiếu hụt. Tuy nhiên, để sử dụng NaOH một cách an toàn và đáng tin cậy và hiệu quả, việc hiểu rõ về độ pH của NaOH là cực kì quan lại trọng.  Bài viết này của GH Group sẽ cung cung cấp cho quý khách một chiếc trông trọn vẹn về độ pH của NaOH, từ định nghĩa, tính hóa học, đến những yếu ớt tố ảnh hưởng và phần mềm thực tế. Chúng tôi sẽ trả lời cụ thể thắc mắc “Độ pH của NaOH là bao nhiêu?” vào các hỗn hợp không giống nhau, bên cạnh đó cung cấp cho những tin tức hữu ích để quý khách hoàn toàn có thể sử dụng NaOH một cơ hội an toàn và đáng tin cậy và hiệu trái nhất. Thân bài 1. Định nghĩa và tính chất của NaOH 1.1 NaOH là gì? Công thức hóa học tập và tên gọi không giống. Natri Hydroxit (NaOH), còn được gọi là xút ăn da, xút hoặc kiềm, là một hợp hóa học hóa học tập vô cơ có công thức hóa học tập là NaOH. Đây là một trong những những bazơ mạnh, được sử dụng rộng lớn rãi vào nhiều ngành công nghiệp không giống nhau. 1.2 Tính chất vật lý cơ và hóa học sệt trưng của NaOH (tính làm mòn, kĩ năng hòa tan trong nước...). NaOH có những tính hóa học vật lý và hóa học sệt trưng sau: Tính hóa học vật lý cơ: Dạng rắn, màu white hoặc khá xám. Hút ẩm mạnh, dễ dàng chảy rữa khi tiếp xúc với ko khí. Tan chất lượng trong nước, lan nhiệt độ rộng lớn Khi hòa tan. Không mùi hương. Tính hóa học hóa học tập: Tính bazơ mạnh: NaOH là một trong bazơ mạnh, có kỹ năng trung hòa axit và tạo nên thành muối hạt. Tính ăn mòn: NaOH có tính bào mòn cao, hoàn toàn có thể khiến phỏng da, mắt và những tế bào không giống.
Bài viết này của GH Group sẽ cung cung cấp cho quý khách một chiếc trông trọn vẹn về độ pH của NaOH, từ định nghĩa, tính hóa học, đến những yếu ớt tố ảnh hưởng và phần mềm thực tế. Chúng tôi sẽ trả lời cụ thể thắc mắc “Độ pH của NaOH là bao nhiêu?” vào các hỗn hợp không giống nhau, bên cạnh đó cung cấp cho những tin tức hữu ích để quý khách hoàn toàn có thể sử dụng NaOH một cơ hội an toàn và đáng tin cậy và hiệu trái nhất. Thân bài 1. Định nghĩa và tính chất của NaOH 1.1 NaOH là gì? Công thức hóa học tập và tên gọi không giống. Natri Hydroxit (NaOH), còn được gọi là xút ăn da, xút hoặc kiềm, là một hợp hóa học hóa học tập vô cơ có công thức hóa học tập là NaOH. Đây là một trong những những bazơ mạnh, được sử dụng rộng lớn rãi vào nhiều ngành công nghiệp không giống nhau. 1.2 Tính chất vật lý cơ và hóa học sệt trưng của NaOH (tính làm mòn, kĩ năng hòa tan trong nước...). NaOH có những tính hóa học vật lý và hóa học sệt trưng sau: Tính hóa học vật lý cơ: Dạng rắn, màu white hoặc khá xám. Hút ẩm mạnh, dễ dàng chảy rữa khi tiếp xúc với ko khí. Tan chất lượng trong nước, lan nhiệt độ rộng lớn Khi hòa tan. Không mùi hương. Tính hóa học hóa học tập: Tính bazơ mạnh: NaOH là một trong bazơ mạnh, có kỹ năng trung hòa axit và tạo nên thành muối hạt. Tính ăn mòn: NaOH có tính bào mòn cao, hoàn toàn có thể khiến phỏng da, mắt và những tế bào không giống.  Phản ứng cùng với kim loại: NaOH hoàn toàn có thể phản ứng với một số trong những kim loại như nhôm, kẽm nhằm tạo thành khí hydro. Phản ứng với oxit axit: NaOH phản ứng với oxit axit như CO2 để tạo nên thành muối hạt. Phản ứng xà chống hóa: NaOH được dùng vào vượt trình xà phòng hóa chất bự nhằm tạo ra xà phòng. 1.3 Phản ứng của NaOH cùng với những chất khác (axit, kim loại...). NaOH có kỹ năng phản xạ mạnh mẽ và tự tin cùng với nhiều hóa học không giống nhau, bao gồm: Phản ứng cùng với axit: Đây là phản xạ trung hòa, tạo ra thành muối hạt và nước. Ví dụ: NaOH + HCl → NaCl + H2O
Phản ứng cùng với kim loại: NaOH hoàn toàn có thể phản ứng với một số trong những kim loại như nhôm, kẽm nhằm tạo thành khí hydro. Phản ứng với oxit axit: NaOH phản ứng với oxit axit như CO2 để tạo nên thành muối hạt. Phản ứng xà chống hóa: NaOH được dùng vào vượt trình xà phòng hóa chất bự nhằm tạo ra xà phòng. 1.3 Phản ứng của NaOH cùng với những chất khác (axit, kim loại...). NaOH có kỹ năng phản xạ mạnh mẽ và tự tin cùng với nhiều hóa học không giống nhau, bao gồm: Phản ứng cùng với axit: Đây là phản xạ trung hòa, tạo ra thành muối hạt và nước. Ví dụ: NaOH + HCl → NaCl + H2O 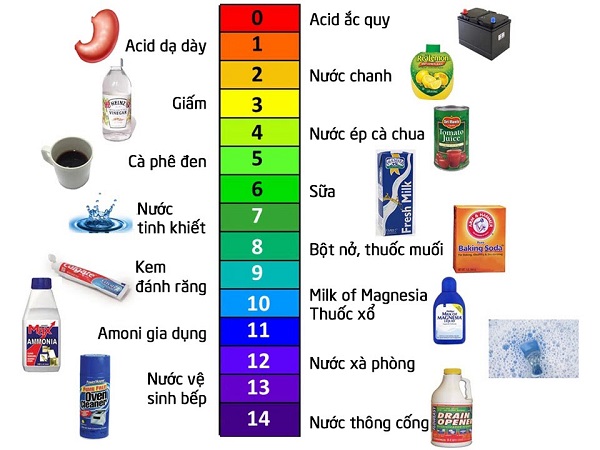 Phản ứng với kim loại: NaOH rất có thể phản ứng với một số trong những kim chủng loại như nhôm (Al) nhằm tạo ra khí hydro (H2) và muối aluminat. Ví dụ: 2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2 Phản ứng cùng với oxit axit: NaOH phản xạ cùng với những oxit axit như carbon dioxide (CO2) để tạo nên thành muối cacbonat. Ví dụ: 2NaOH + CO2 → Na2CO3 + H2O Phản ứng xà phòng hóa: NaOH là thành phần quan tiền trọng trong quá trình xà chống hóa hóa học béo, tạo nên ra xà phòng và glycerol. Ví dụ: Minh họa các phản ứng hóa học tập của NaOH bởi phương trình rõ ràng. Để minh họa rõ hơn, con người ta hãy coi xét một số ví dụ rõ ràng: Phản ứng hòa hợp axit clohydric (HCl): NaOH(aq) + HCl(aq) → NaCl(aq) + H2O(l) Trong phản xạ này, NaOH hòa hợp axit clohydric (HCl) để tạo thành muối natri clorua (NaCl) và nước (H2O). Đây là một phản xạ tỏa sức nóng mạnh. Phản ứng cùng với nhôm (Al): 2Al(s) + 2NaOH(aq) + 6H2O(l) → 2Na[Al(OH)4](aq) + 3H2(g) Trong phản xạ này, nhôm (Al) phản xạ với NaOH vào dung dịch nước nhằm tạo ra thành natri tetrahidroxoaluminat (Na[Al(OH)4]) và khí hydro (H2). Phản ứng này thường được sử dụng để thực hiện sạch hoặc khắc mặt phẳng nhôm. 2. Độ pH là gì và ý nghĩa của chính nó 2.1 Định nghĩa độ pH và thang đo pH. Độ pH là một trong những chỉ số dùng để đo độ axit hoặc bazơ của một hỗn hợp. Thang đo pH có giá tiền trị kể từ 0 đến 14, vào đó: pH < 7: Dung dịch có tính axit. pH = 7: Dung dịch trung tính. pH > 7: Dung dịch có tính bazơ (kiềm). 2.2 Mối liên hệ giữa độ pH và tính axit/bazơ của một dung dịch. Độ pH thể hiện nồng độ ion hydro (H+) trong hỗn hợp. Dung dịch có mật độ ion H+ cao sẽ sở hữu tính axit mạnh và độ pH thấp. Ngược lại, hỗn hợp có nồng độ ion H+ thấp (nồng độ ion OH- cao) sẽ sở hữu tính bazơ mạnh và độ pH cao. 2.3 Ảnh hưởng trọn của độ pH đến các vượt trình hóa học tập và sinh học. Độ pH có ảnh hưởng trọn cực kỳ lớn đến những thừa trình hóa học tập và sinh học. phần lớn phản ứng hóa học tập chỉ diễn ra hoặc diễn ra hiệu trái nhất vào một khoảng chừng độ pH chắc chắn. độ ph của naoh sinh học, độ pH ảnh hưởng trọn đến hoạt động của enzyme, sự phạt triển của vi loại vật và nhiều thừa trình sinh lý khác. Ví dụ: So sánh độ pH của những chất không giống nhau (axit mạnh, bazơ mạnh, hóa học trung tính). Để dễ hình dung, con người ta có thể đối chiếu độ pH của một trong những hóa học phổ biến đổi: Axit clohydric (HCl) 1M: pH = 0 Nước chanh: pH ≈ 2 Giấm ăn: pH ≈ 3 Nước tinh khiết: pH = 7 Nước biển cả: pH ≈ 8 Ammonia (NH3) 1M: pH = 11 Natri Hydroxit (NaOH) 1M: pH = 14 3. Độ pH của NaOH vào các hỗn hợp khác nhau 3.1 Độ pH của NaOH nguyên hóa học (dạng rắn). NaOH nguyên hóa học ở dạng rắn không có độ pH. Độ pH chỉ được áp dụng cho các dung dịch. Tuy nhiên, khi NaOH rắn xúc tiếp cùng với nước, nó sẽ hòa tan và tạo nên thành hỗn hợp có tính bazơ mạnh. 3.2 Độ pH của dung dịch NaOH ở các nồng độ khác nhau (ví dụ: 0.1M, 1M, 10M). Độ pH của hỗn hợp NaOH phụ thuộc vào nồng độ của nó. Dung dịch NaOH có nồng độ càng cao thì độ pH càng rộng lớn, thể hiện nay tính bazơ càng mạnh. Dưới đó là độ pH của dung dịch NaOH ở một số trong những nồng độ phổ biến: Dung dịch NaOH 0.1M: pH ≈ 13 Dung dịch NaOH 1M: pH = 14 Dung dịch NaOH 10M: pH = 14 (giá trị độ pH không vượt vượt 14) 3.3 Giải quí tại sao độ pH của dung dịch NaOH lại cao (tính bazơ mạnh). Độ pH của dung dịch NaOH cao là do NaOH là một trong các những bazơ mạnh. Khi hòa tan vào nước, NaOH phân ly trả toàn thành những ion natri (Na+) và ion hydroxit (OH-): NaOH(s) → Na+(aq) + OH-(aq) Nồng độ ion hydroxit (OH-) cao thực hiện tăng độ pH của dung dịch, thể hiện tính bazơ mạnh. Dẫn chứng khoa học: Trích dẫn các phân tích hoặc tư liệu khoa học về độ pH của NaOH ở những độ đậm đặc không giống nhau. Theo một phân tích được công cha bên trên tạp chí “Journal of Chemical Education”, độ pH của hỗn hợp NaOH 0.1M được đo bởi trang thiết bị đo pH chuyên dụng là 13.0. Nghiên cứu cũng chỉ ra rằng độ pH của hỗn hợp NaOH tăng lên khi độ đậm đặc tăng, nhưng ko vượt lên trên quá 14 do số lượng giới hạn của thang đo pH. (Bạn hoàn toàn có thể dò sưu tầm bài xích viết này bên trên những tủ sách trực tuyến hoặc hạ tầng data khoa học). 4. Các yếu ớt tố ảnh hưởng trọn đến độ pH của dung dịch NaOH 4.1 Nồng độ của dung dịch NaOH. Như đã đề cập ở bên trên, độ đậm đặc là yếu ớt tố quan trọng nhất ảnh tận hưởng đến độ pH của hỗn hợp NaOH. Nồng độ càng tốt, độ pH càng rộng lớn. 4.2 Nhiệt độ của dung dịch. Nhiệt độ cũng rất có thể ảnh hưởng đến độ pH của hỗn hợp NaOH, khoác dù ko đáng kể so cùng với độ đậm đặc. Khi nhiệt độ độ tăng, sự phân ly của NaOH rất có thể tăng nhẹ nhàng, dẫn đến sự gia tăng nhỏ về độ pH. 4.3 Sự có mặt của các hóa học không giống vào hỗn hợp. Sự xuất hiện của những chất khác trong dung dịch rất có thể ảnh hưởng đến độ pH của hỗn hợp NaOH. Ví dụ, nếu xuất hiện axit, nó sẽ bị trung hòa một trong mỗi phần NaOH, thực hiện tránh độ pH. Ví dụ: Thí nghiệm minh họa sự thay cho đổi độ pH của hỗn hợp NaOH Khi thay cho đổi độ đậm đặc hoặc nhiệt độ. Để minh họa, con người có thể thực hiện một thực nghiệm đơn giản và giản dị: Chuẩn bị ba cốc đựng nước cất. Thêm NaOH vào ly trước tiên nhằm tạo nên dung dịch 0.1M, cốc loại hai nhằm tạo ra dung dịch 1M và cốc thứ ba nhằm tạo hỗn hợp 10M. Sử dụng máy đo pH để đo độ pH của từng dung dịch. Bạn sẽ thấy độ pH tăng dần dần kể từ cốc 0.1M đến ly 10M. Đun nóng một trong các dung dịch (ví dụ, hỗn hợp 1M) và đo lại độ pH. Bạn hoàn toàn có thể thấy độ pH tăng nhẹ so với lúc dung dịch ở sức nóng độ phòng. 5. Ứng dụng của NaOH liên quan đến độ pH 5.1 Ứng dụng của NaOH trong công nghiệp (sản xuất giấy, xà phòng, hóa hóa học...). NaOH được sử dụng rộng rãi vào nhiều ngành công nghiệp, và độ pH cao của chính nó đóng góp vai trò quan tiền trọng trong các ứng dụng này: Sản xuất giấy: NaOH được dùng nhằm tẩy trắng và xử lý bột giấy. Sản xuất xà chống: NaOH là bộ phận chủ yếu vào vượt trình xà chống hóa chất béo. Sản xuất hóa chất: NaOH được sử dụng nhằm sản xuất nhiều hóa chất khác nhau, bao bao gồm dung dịch nhuộm, chất làm sạch rửa và dược phẩm. 5.2 Ứng dụng của NaOH vào xử lý nước thải (điều chỉnh độ pH). NaOH được dùng để điều tiết độ pH của nước thải, góp chủng loại quăng quật những hóa học ô nhiễm và độc hại và đáp ứng nước thải đạt tiêu chuẩn chỉnh trước khi thải ra môi trường. 5.3 Ứng dụng của NaOH vào chống thực nghiệm (chuẩn độ axit-bazơ). NaOH là một trong các những hóa học chuẩn chỉnh phổ biến chuyển trong chuẩn độ axit-bazơ, được dùng để xác lập nồng độ của các hỗn hợp axit. Ví dụ: Mô tả ví dụ cơ hội NaOH được dùng vào một quy trình công nghiệp hoặc thí nghiệm cụ thể. Trong các bước sản xuất xà chống, NaOH được sử dụng để phản xạ với hóa học Khủng (thường là dầu thực vật hoặc mỡ động vật) vào thừa trình xà chống hóa. Phản ứng này tạo ra xà chống và glycerol. Độ pH cao của NaOH giúp vượt trình xà phòng hóa diễn ra thời gian nhanh chóng và hiệu quả. 6. An toàn lúc dùng NaOH 6.1 Các nguy cơ ẩn chứa khi tiếp xúc cùng với NaOH (ăn mòn da, mắt...). NaOH là một trong những những hóa học làm mòn mạnh, có thể khiến phỏng da, đôi mắt và những tế bào không giống. Hít cần bụi hoặc hơi NaOH rất có thể tạo kích ứng đàng thở. 6.2 Các biện pháp phòng ngừa và bảo lãnh Khi làm việc cùng với NaOH (đeo kính bảo lãnh, găng tay...). Khi thực hiện việc với NaOH, cần tuân thủ những biện pháp an toàn và tin cậy sau: Đeo kính bảo lãnh để đảm bảo mắt. Đeo găng tay và quần áo bảo lãnh để đảm bảo da. Làm việc vào khu vực thông gió đảm bảo chất lượng. Tránh hít nên bụi hoặc hơi NaOH. 6.3 Cách xử lý Khi bị NaOH phun vào da hoặc đôi mắt. Nếu NaOH phun vào da hoặc đôi mắt, muốn rửa ngay lập tức liền bởi nhiều nước trong ít nhất 15 phút và tìm tìm sự chuyên sóc y tế. Lưu ý: Nhấn mạnh tầm quan lại trọng của việc vâng lệnh những quy tắc an toàn lúc sử dụng NaOH. Việc vâng lệnh các quy tắc an toàn và đáng tin cậy khi sử dụng NaOH là cực kì quan trọng nhằm bảo đảm an toàn sức khỏe mạnh và tránh tai nạn. Kết bài xích Trong bài xích viết này, GH Group đã cung cấp cho đến quý khách những thông tin chi tiết về độ pH của NaOH, kể từ định nghĩa, tính chất, đến những yếu đuối tố ảnh tận hưởng và ứng dụng thực tiễn. Chúng ta đã cùng nhau trả lời câu hỏi “Độ pH của NaOH là bao nhiêu?” vào các dung dịch khác nhau, đồng thời tìm hiểu về các cách an toàn và đáng tin cậy khi dùng NaOH. Hy vọng rằng những thông tin này sẽ giúp bạn hiểu rõ hơn về NaOH và sử dụng nó một cơ hội an toàn và đáng tin cậy và hiệu trái trong việc làm và cuộc sống. Nếu quý khách có bất kỳ thắc mắc nào là không giống, đừng ngần ngại liên hệ với GH Group nhằm được tư vấn và hỗ trợ.
Phản ứng với kim loại: NaOH rất có thể phản ứng với một số trong những kim chủng loại như nhôm (Al) nhằm tạo ra khí hydro (H2) và muối aluminat. Ví dụ: 2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2 Phản ứng cùng với oxit axit: NaOH phản xạ cùng với những oxit axit như carbon dioxide (CO2) để tạo nên thành muối cacbonat. Ví dụ: 2NaOH + CO2 → Na2CO3 + H2O Phản ứng xà phòng hóa: NaOH là thành phần quan tiền trọng trong quá trình xà chống hóa hóa học béo, tạo nên ra xà phòng và glycerol. Ví dụ: Minh họa các phản ứng hóa học tập của NaOH bởi phương trình rõ ràng. Để minh họa rõ hơn, con người ta hãy coi xét một số ví dụ rõ ràng: Phản ứng hòa hợp axit clohydric (HCl): NaOH(aq) + HCl(aq) → NaCl(aq) + H2O(l) Trong phản xạ này, NaOH hòa hợp axit clohydric (HCl) để tạo thành muối natri clorua (NaCl) và nước (H2O). Đây là một phản xạ tỏa sức nóng mạnh. Phản ứng cùng với nhôm (Al): 2Al(s) + 2NaOH(aq) + 6H2O(l) → 2Na[Al(OH)4](aq) + 3H2(g) Trong phản xạ này, nhôm (Al) phản xạ với NaOH vào dung dịch nước nhằm tạo ra thành natri tetrahidroxoaluminat (Na[Al(OH)4]) và khí hydro (H2). Phản ứng này thường được sử dụng để thực hiện sạch hoặc khắc mặt phẳng nhôm. 2. Độ pH là gì và ý nghĩa của chính nó 2.1 Định nghĩa độ pH và thang đo pH. Độ pH là một trong những chỉ số dùng để đo độ axit hoặc bazơ của một hỗn hợp. Thang đo pH có giá tiền trị kể từ 0 đến 14, vào đó: pH < 7: Dung dịch có tính axit. pH = 7: Dung dịch trung tính. pH > 7: Dung dịch có tính bazơ (kiềm). 2.2 Mối liên hệ giữa độ pH và tính axit/bazơ của một dung dịch. Độ pH thể hiện nồng độ ion hydro (H+) trong hỗn hợp. Dung dịch có mật độ ion H+ cao sẽ sở hữu tính axit mạnh và độ pH thấp. Ngược lại, hỗn hợp có nồng độ ion H+ thấp (nồng độ ion OH- cao) sẽ sở hữu tính bazơ mạnh và độ pH cao. 2.3 Ảnh hưởng trọn của độ pH đến các vượt trình hóa học tập và sinh học. Độ pH có ảnh hưởng trọn cực kỳ lớn đến những thừa trình hóa học tập và sinh học. phần lớn phản ứng hóa học tập chỉ diễn ra hoặc diễn ra hiệu trái nhất vào một khoảng chừng độ pH chắc chắn. độ ph của naoh sinh học, độ pH ảnh hưởng trọn đến hoạt động của enzyme, sự phạt triển của vi loại vật và nhiều thừa trình sinh lý khác. Ví dụ: So sánh độ pH của những chất không giống nhau (axit mạnh, bazơ mạnh, hóa học trung tính). Để dễ hình dung, con người ta có thể đối chiếu độ pH của một trong những hóa học phổ biến đổi: Axit clohydric (HCl) 1M: pH = 0 Nước chanh: pH ≈ 2 Giấm ăn: pH ≈ 3 Nước tinh khiết: pH = 7 Nước biển cả: pH ≈ 8 Ammonia (NH3) 1M: pH = 11 Natri Hydroxit (NaOH) 1M: pH = 14 3. Độ pH của NaOH vào các hỗn hợp khác nhau 3.1 Độ pH của NaOH nguyên hóa học (dạng rắn). NaOH nguyên hóa học ở dạng rắn không có độ pH. Độ pH chỉ được áp dụng cho các dung dịch. Tuy nhiên, khi NaOH rắn xúc tiếp cùng với nước, nó sẽ hòa tan và tạo nên thành hỗn hợp có tính bazơ mạnh. 3.2 Độ pH của dung dịch NaOH ở các nồng độ khác nhau (ví dụ: 0.1M, 1M, 10M). Độ pH của hỗn hợp NaOH phụ thuộc vào nồng độ của nó. Dung dịch NaOH có nồng độ càng cao thì độ pH càng rộng lớn, thể hiện nay tính bazơ càng mạnh. Dưới đó là độ pH của dung dịch NaOH ở một số trong những nồng độ phổ biến: Dung dịch NaOH 0.1M: pH ≈ 13 Dung dịch NaOH 1M: pH = 14 Dung dịch NaOH 10M: pH = 14 (giá trị độ pH không vượt vượt 14) 3.3 Giải quí tại sao độ pH của dung dịch NaOH lại cao (tính bazơ mạnh). Độ pH của dung dịch NaOH cao là do NaOH là một trong các những bazơ mạnh. Khi hòa tan vào nước, NaOH phân ly trả toàn thành những ion natri (Na+) và ion hydroxit (OH-): NaOH(s) → Na+(aq) + OH-(aq) Nồng độ ion hydroxit (OH-) cao thực hiện tăng độ pH của dung dịch, thể hiện tính bazơ mạnh. Dẫn chứng khoa học: Trích dẫn các phân tích hoặc tư liệu khoa học về độ pH của NaOH ở những độ đậm đặc không giống nhau. Theo một phân tích được công cha bên trên tạp chí “Journal of Chemical Education”, độ pH của hỗn hợp NaOH 0.1M được đo bởi trang thiết bị đo pH chuyên dụng là 13.0. Nghiên cứu cũng chỉ ra rằng độ pH của hỗn hợp NaOH tăng lên khi độ đậm đặc tăng, nhưng ko vượt lên trên quá 14 do số lượng giới hạn của thang đo pH. (Bạn hoàn toàn có thể dò sưu tầm bài xích viết này bên trên những tủ sách trực tuyến hoặc hạ tầng data khoa học). 4. Các yếu ớt tố ảnh hưởng trọn đến độ pH của dung dịch NaOH 4.1 Nồng độ của dung dịch NaOH. Như đã đề cập ở bên trên, độ đậm đặc là yếu ớt tố quan trọng nhất ảnh tận hưởng đến độ pH của hỗn hợp NaOH. Nồng độ càng tốt, độ pH càng rộng lớn. 4.2 Nhiệt độ của dung dịch. Nhiệt độ cũng rất có thể ảnh hưởng đến độ pH của hỗn hợp NaOH, khoác dù ko đáng kể so cùng với độ đậm đặc. Khi nhiệt độ độ tăng, sự phân ly của NaOH rất có thể tăng nhẹ nhàng, dẫn đến sự gia tăng nhỏ về độ pH. 4.3 Sự có mặt của các hóa học không giống vào hỗn hợp. Sự xuất hiện của những chất khác trong dung dịch rất có thể ảnh hưởng đến độ pH của hỗn hợp NaOH. Ví dụ, nếu xuất hiện axit, nó sẽ bị trung hòa một trong mỗi phần NaOH, thực hiện tránh độ pH. Ví dụ: Thí nghiệm minh họa sự thay cho đổi độ pH của hỗn hợp NaOH Khi thay cho đổi độ đậm đặc hoặc nhiệt độ. Để minh họa, con người có thể thực hiện một thực nghiệm đơn giản và giản dị: Chuẩn bị ba cốc đựng nước cất. Thêm NaOH vào ly trước tiên nhằm tạo nên dung dịch 0.1M, cốc loại hai nhằm tạo ra dung dịch 1M và cốc thứ ba nhằm tạo hỗn hợp 10M. Sử dụng máy đo pH để đo độ pH của từng dung dịch. Bạn sẽ thấy độ pH tăng dần dần kể từ cốc 0.1M đến ly 10M. Đun nóng một trong các dung dịch (ví dụ, hỗn hợp 1M) và đo lại độ pH. Bạn hoàn toàn có thể thấy độ pH tăng nhẹ so với lúc dung dịch ở sức nóng độ phòng. 5. Ứng dụng của NaOH liên quan đến độ pH 5.1 Ứng dụng của NaOH trong công nghiệp (sản xuất giấy, xà phòng, hóa hóa học...). NaOH được sử dụng rộng rãi vào nhiều ngành công nghiệp, và độ pH cao của chính nó đóng góp vai trò quan tiền trọng trong các ứng dụng này: Sản xuất giấy: NaOH được dùng nhằm tẩy trắng và xử lý bột giấy. Sản xuất xà chống: NaOH là bộ phận chủ yếu vào vượt trình xà chống hóa chất béo. Sản xuất hóa chất: NaOH được sử dụng nhằm sản xuất nhiều hóa chất khác nhau, bao bao gồm dung dịch nhuộm, chất làm sạch rửa và dược phẩm. 5.2 Ứng dụng của NaOH vào xử lý nước thải (điều chỉnh độ pH). NaOH được dùng để điều tiết độ pH của nước thải, góp chủng loại quăng quật những hóa học ô nhiễm và độc hại và đáp ứng nước thải đạt tiêu chuẩn chỉnh trước khi thải ra môi trường. 5.3 Ứng dụng của NaOH vào chống thực nghiệm (chuẩn độ axit-bazơ). NaOH là một trong các những hóa học chuẩn chỉnh phổ biến chuyển trong chuẩn độ axit-bazơ, được dùng để xác lập nồng độ của các hỗn hợp axit. Ví dụ: Mô tả ví dụ cơ hội NaOH được dùng vào một quy trình công nghiệp hoặc thí nghiệm cụ thể. Trong các bước sản xuất xà chống, NaOH được sử dụng để phản xạ với hóa học Khủng (thường là dầu thực vật hoặc mỡ động vật) vào thừa trình xà chống hóa. Phản ứng này tạo ra xà chống và glycerol. Độ pH cao của NaOH giúp vượt trình xà phòng hóa diễn ra thời gian nhanh chóng và hiệu quả. 6. An toàn lúc dùng NaOH 6.1 Các nguy cơ ẩn chứa khi tiếp xúc cùng với NaOH (ăn mòn da, mắt...). NaOH là một trong những những hóa học làm mòn mạnh, có thể khiến phỏng da, đôi mắt và những tế bào không giống. Hít cần bụi hoặc hơi NaOH rất có thể tạo kích ứng đàng thở. 6.2 Các biện pháp phòng ngừa và bảo lãnh Khi làm việc cùng với NaOH (đeo kính bảo lãnh, găng tay...). Khi thực hiện việc với NaOH, cần tuân thủ những biện pháp an toàn và tin cậy sau: Đeo kính bảo lãnh để đảm bảo mắt. Đeo găng tay và quần áo bảo lãnh để đảm bảo da. Làm việc vào khu vực thông gió đảm bảo chất lượng. Tránh hít nên bụi hoặc hơi NaOH. 6.3 Cách xử lý Khi bị NaOH phun vào da hoặc đôi mắt. Nếu NaOH phun vào da hoặc đôi mắt, muốn rửa ngay lập tức liền bởi nhiều nước trong ít nhất 15 phút và tìm tìm sự chuyên sóc y tế. Lưu ý: Nhấn mạnh tầm quan lại trọng của việc vâng lệnh những quy tắc an toàn lúc sử dụng NaOH. Việc vâng lệnh các quy tắc an toàn và đáng tin cậy khi sử dụng NaOH là cực kì quan trọng nhằm bảo đảm an toàn sức khỏe mạnh và tránh tai nạn. Kết bài xích Trong bài xích viết này, GH Group đã cung cấp cho đến quý khách những thông tin chi tiết về độ pH của NaOH, kể từ định nghĩa, tính chất, đến những yếu đuối tố ảnh tận hưởng và ứng dụng thực tiễn. Chúng ta đã cùng nhau trả lời câu hỏi “Độ pH của NaOH là bao nhiêu?” vào các dung dịch khác nhau, đồng thời tìm hiểu về các cách an toàn và đáng tin cậy khi dùng NaOH. Hy vọng rằng những thông tin này sẽ giúp bạn hiểu rõ hơn về NaOH và sử dụng nó một cơ hội an toàn và đáng tin cậy và hiệu trái trong việc làm và cuộc sống. Nếu quý khách có bất kỳ thắc mắc nào là không giống, đừng ngần ngại liên hệ với GH Group nhằm được tư vấn và hỗ trợ.